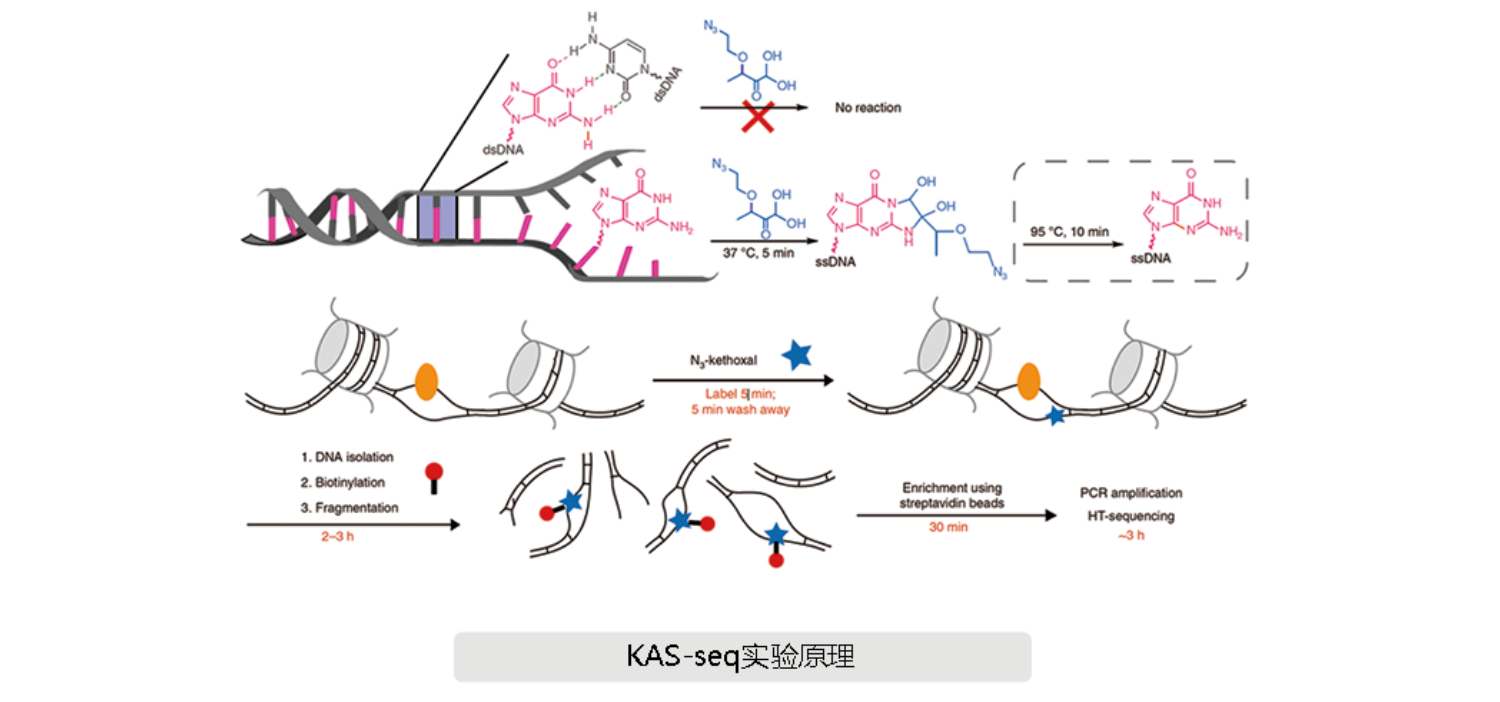
KAS-Seq是芝加哥大学化学系的何川教授团队2020年4月发表在Nature Methods上的全新方法。KAS-seq可在全基因组范围内快速、敏感地检测和定位由转录或其他过程、产生的ssDNA,且只需使用1000个细胞即可实现。该方法基于N3-kethoxal和鸟嘌呤在ssDNA中快速而特异性的反应开发。
N3-kethoxal是用于单链DNA测序、转录组、基因组Kas-seq的小分子化合物,能够在5分钟内特异性的和活细胞中单链状态的鸟嘌呤反应,被修饰的RNA片段可通过相互作用富集。
低起始量,高通量;快速准确的分析转录动态变化和增强子活性;广泛应用于研究转录调控。

转录与转录调控过程决定细胞命运及其生理功能,转录调控功能障碍往往与人类疾病密切相关。然而,现有检测转录调控的方法(如:Pol II ChIP-Seq、检测新生RNA水平等)仍存在一定的局限性。如,检测起始材料需求量大且操作复杂、Pol II ChIP-Seq不能区分RNA聚合酶是简单结合还是积极参与转录、此外,检测新生RNA水平忽略了大多数RNA会经过转录后处理的过程,可能无法准确反应原位转录动态。
本文研究者认为,转录过程中会在基因组中产生单链DNA(ssDNA),以“转录气泡”的形式存在。他们利用N 3 -kethoxal能与ssDNA中鸟嘌呤快速特异性反应的特点,开发了KAS-Seq(kethoxal-assisted single-stranded DNA sequencing)方法。该方法可快速(5 min)、灵敏(仅需1000个细胞)的捕获由RNA聚合酶或其他过程原位产生的ssDNA。此外,通过KAS-Seq能进一步表征ssDNA上的活性增强子。
HEK293T 细胞、小鼠胚胎干细胞(mESCs)
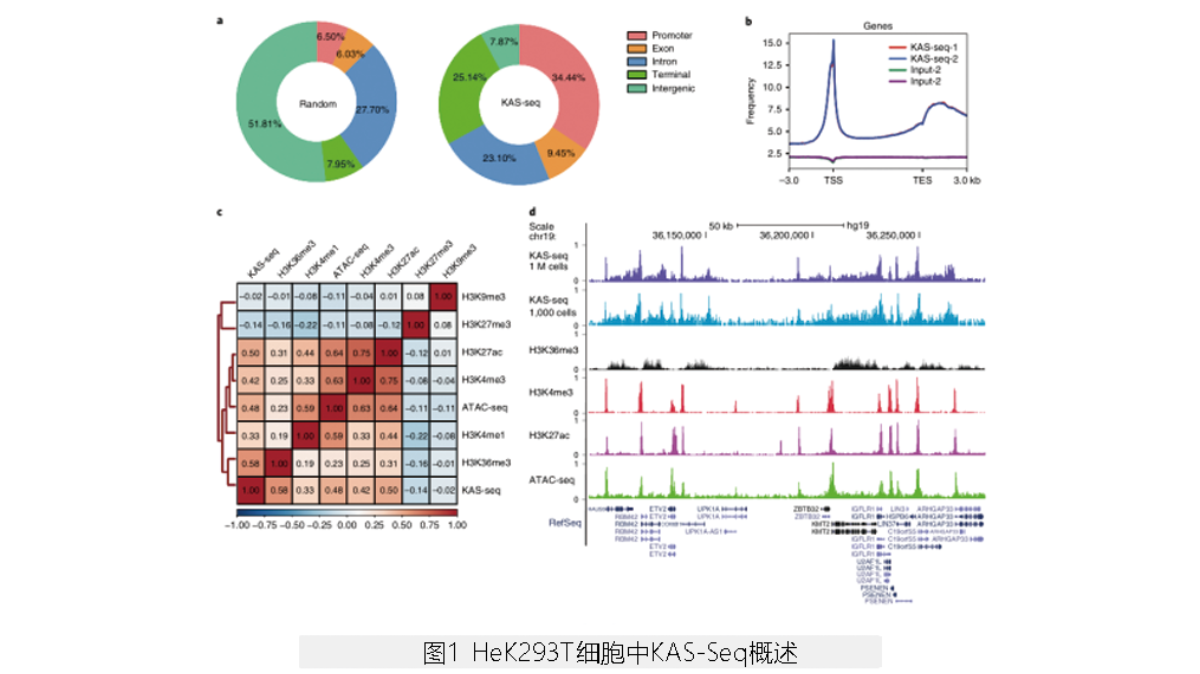
1. KAS-Seq信号标志转录活性
KAS-Seq所产生的reads在基因编码区(尤其是基因启动子和转录终止区)大量富集,而在基因间区缺失(图1a)。在基因编码区的KAS-Seq峰图显示,在转录起始位点(TSS)周围的峰强而尖锐、覆盖整个基因体的信号相对较弱而宽、从转录末端到下游区域的峰强而宽(图1b)。KAS-Seq信号与标记转录活性的组蛋白修饰(如H3K4me3、H3K27ac、H3K36me3)呈正相关,与不活跃的染色质标记(H3K27me3 and H3K9me3)呈负相关(图1c)。在TSS上,KAS-Seq信号与H3K4me3和H3K27ac信号重叠,基因体上的KAS-Seq信号与H3K36me3信号重叠(图1d)。
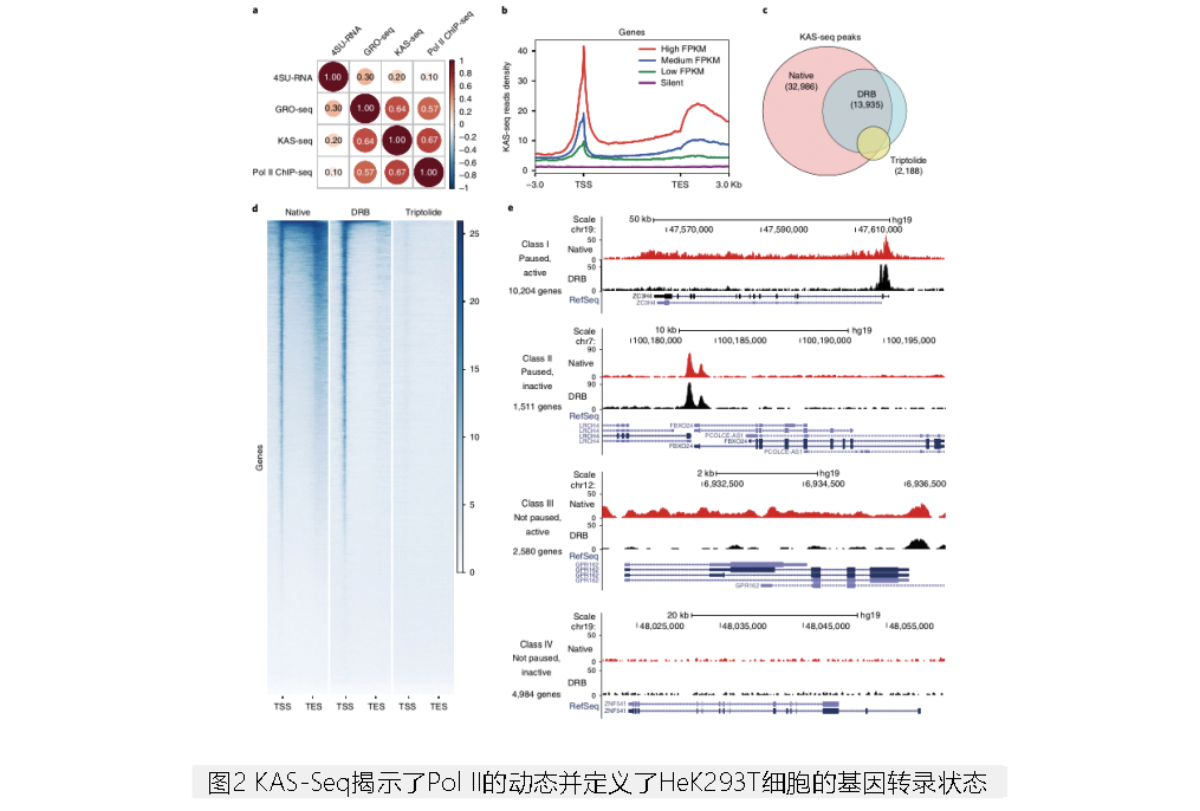
2. KAS-Seq揭示参与转录的Pol II动态
通过与GRO-seq和Pol II ChIP-seq结果进行比较,发现KAS-Seq结果与上述二者的相关性较强(图2a),且在低表达水平的基因中, KAS-Seq信号强度未明显下降(图2b)。分别用DRB(5,6-dichlorobenzimidazole 1-β-d-ribofuranoside)抑制Pol II从TSS释放、用雷公藤甲素(triptolide)抑制Pol II招募时,KAS-Seq峰的数量显著下降(图2c)。伴随着TSS信号的增加,DRB严重减弱了基因体和转录终止区的ssDNA信号,雷公藤甲素几乎完全消除了整个基因编码区域的所有信号(图2d)。这表明基因体上的KAS-Seq信号来源于转录延伸。
3. 许多增强子区域是单链的,与更高的增强子活性相关
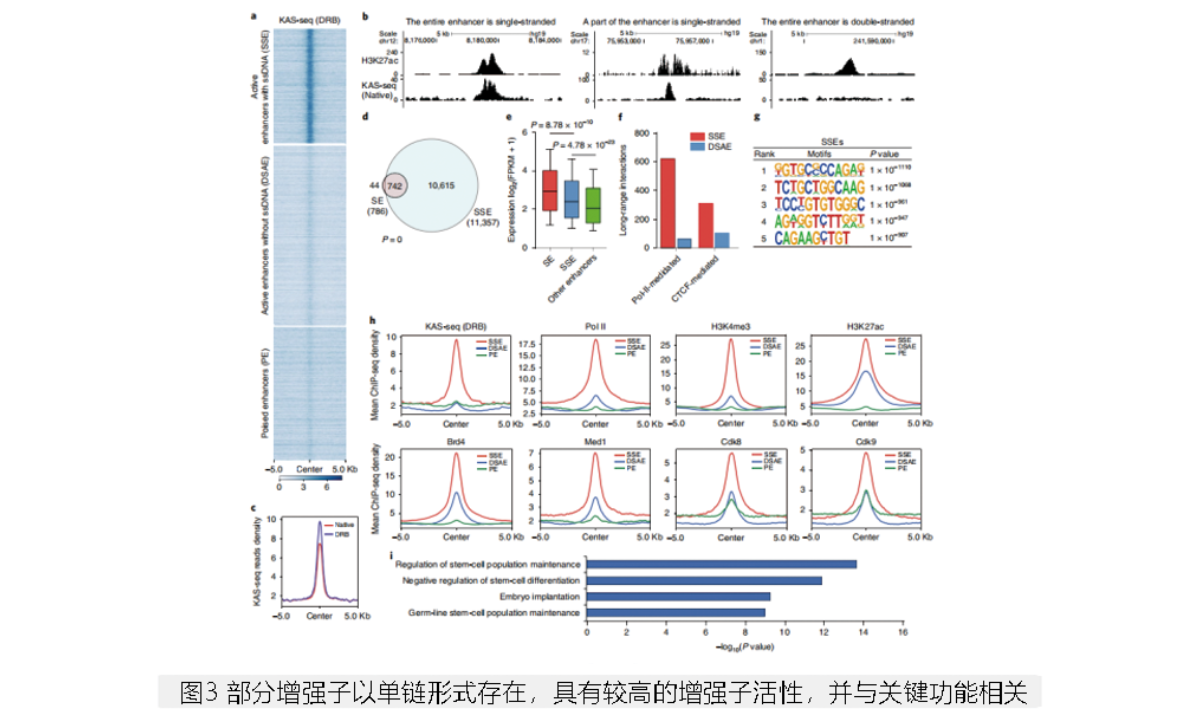
KAS-Seq可以识别那些正在被Pol II转录的增强子,研究者将具有KAS-Seq峰的增强子定义为单链DNA中的增强子(ssDNA-containing enhancer, SSE)。因为一些增强子位于基因体中,研究者对DRB处理后的KAS-Seq数据进行SSEs注释,以发现来自于转录延伸的ssDNA信号。在mESCs中,约25%的增强子被定义为SSE,大多数增强子不显示KAS-Seq信号(图3a,b)。ssDNA包含的增强子中,KAS-Seq信号倾向于在DRB处理后增加(图3c),支持增强子转录暂停和延长的存在。94%的超级增强子属于ssDNA包含的增强子,说明大多数增强子是被积极转录的(图3d)。SSEs相关基因表达水平较高(图3e),且SSEs在CTCF和Pol II介导下具有更远距离的相互作用(图3f),说明这些转录增强子可能具有更强的激活靶基因的能力。
Kethoxal-assisted single-stranded DNA sequencing captures global transcription dynamics and enhancer activity in situ. Nature Methods (2020). https://doi.org/10.1038/s41592-020-0797-9
| 样品类型 | 样品要求 |
|---|---|
| 细胞 | 1-500 million |
| 制备材料及仪器 | 样品准备步骤 | ||||
|---|---|---|---|---|---|
| 试剂及材料准备 | N3 kethoxal分子试剂(由伟寰生物配置并提供,联系对接销售人员获取) | ||||
| 实验步骤 |
|
||||
| 贴壁细胞 |
|
||||
| 悬浮细胞 |
|
||||
| 注:详细的N3-kethoxal稀释液制备及N3-kethoxal培养液制备请在确认送样前咨询销售,我们将会针对您的样本提出更为细致的方案。 | |||||
| 样品包装 | 容器 | 条件 |
|---|---|---|
| 细胞 | 1.5 ml EP管+15 ml离心管 | 干冰运输 |
|
注意事项:1. 所有样品必须标记管上注明样品名称、制备时间且与样品登记单信息一致。 2. 将填写的KAS测序样品信息表格随样品一起运送。 |
||
1. 样品寄送时应采用三级包装系统: 第一层容器装样品,要求防渗漏;第二层要求耐受性好、容纳并保护第一层容器;第三层容器放在一个运输用外层包装内。
2. 干冰运输应釆用壁厚且质量完好的泡沫箱,材料用编号后的冻存管存放,用密封袋包装后埋入干冰中,泡沬箱应扣严并用封箱带封严。
3. 运输过程确保足量的干冰,防止干冰挥发导致样品降解。干冰运输可委托顺丰快递,一定要确保48小时送达。24小时到达的,干冰数量不得低于6公斤;48小时到达的,干冰数量不得低于10公斤。夏季适当增加干冰(1.5倍)。超过48小时到达的,建议不要用此法运输。
