转录组测序,对某一物种或特定细胞在某一功能状态下产生的总RNA进行高通量测序,但现阶段该技术主要检测mRNA。转录组测序既可以检测基因表达水平差异,又可以提供结构分析,发现未知转录本和稀有转录本,精确地识别差异可变剪切位点、基因融合、SNP以及InDel突变等。现该测序技术无需预先针对已知序列设计探针,即可对任意物种的整体转录活动进行检测,提供更精确的数字化信号、更高的检测通量以及更广泛的检测范围,是目前深入研究转录组的强大工具。目前转录组测序已广泛应用于动植物经济性状, 遗传改良,生长发育调控机制,人类重大疾病发病机制等研究。


代谢组和转录组测序揭示山茶粉色花朵花青素代谢
期刊:Molecules 影响因子:4.1 发表时间:2019年3月
几乎所有茶树的花朵(茶花)都是白色的,这导致研究人员几乎不关注茶花中花青素(anthocyanin)的积累和颜色变化。广东白塘山发 现了一个新的紫芽品种即白塘紫茶(BTP),它的花朵呈天然粉色,这为了解茶花花青素代谢网络和花色形成提供了机会
在同一天收集白塘紫茶生长发育五个阶段的花卉样品,这五个发育阶段为:花蕾阶段(BTP1),花瓣开始分裂阶段(BTP2),半开花阶 段(BTP3),盛开阶段(BTP4)和枯萎阶段(BTP5)。每个阶段包含来自不同茶树的三个生物学重复样本,共计15个样本。
对来自五个阶段的花卉样品进行转录组测序和非靶向代谢组(UPLC-ESI-MS/MS系统)的定性定量,后进行转录组和非靶向代谢分析。
1.茶花在五个生长阶段代谢产物的变化
在同一天收集白塘紫茶生长发育五个阶段的花卉样品,这五个发育阶段为:花蕾阶段(BTP1),花瓣开始分裂阶段(BTP2),半开花阶 段(BTP3),盛开阶段(BTP4)和枯萎阶段(BTP5)。每个阶段包含来自不同茶树的三个生物学重复样本,共计15个样本。
2.紫色茶花五个阶段的差异基因分析
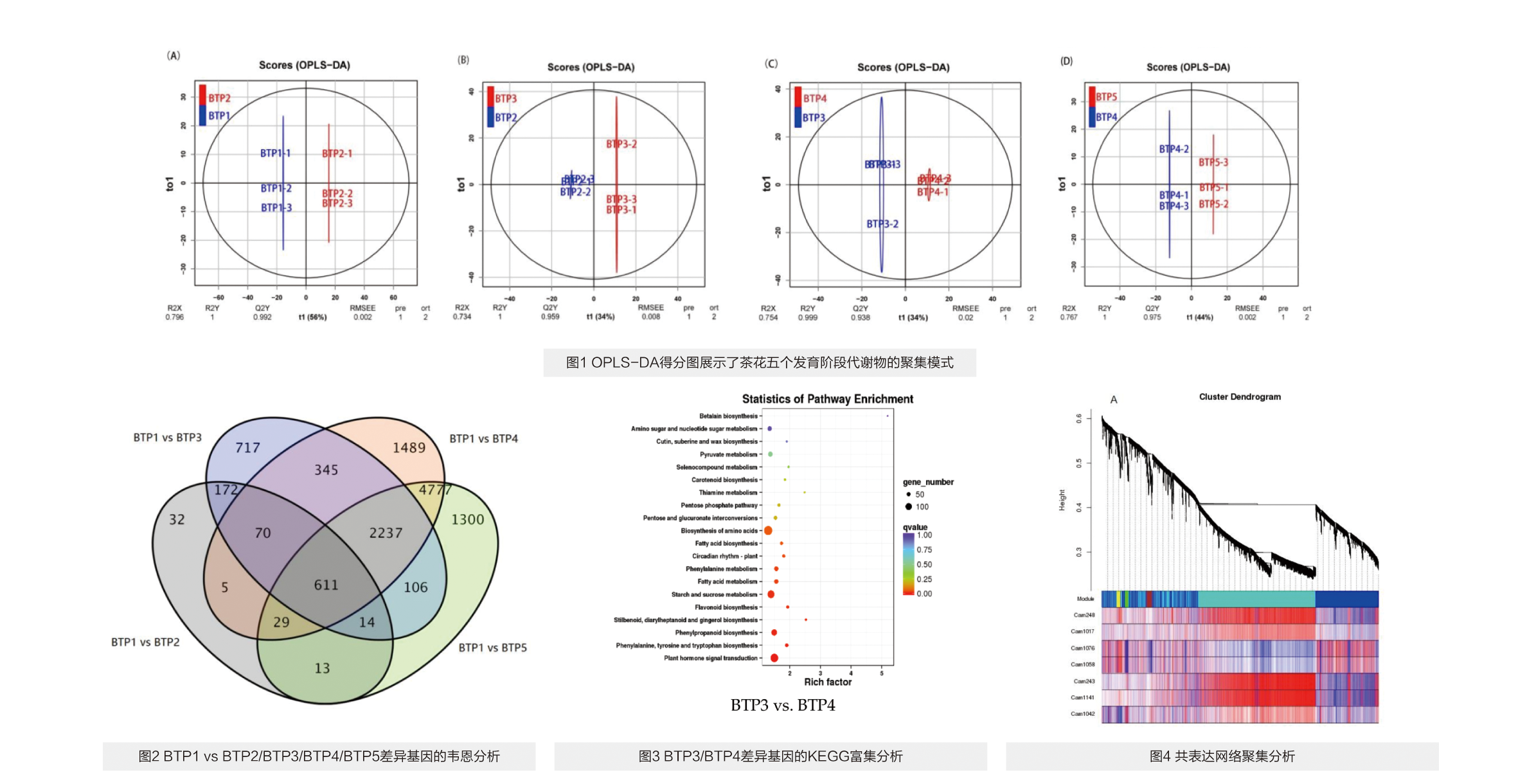
采用KEGG功能富集分析共鉴定到了21个与花青素通路相关的差异表达基因(DEG)。使用维恩分析和KEGG功能富集分析筛选了在花 朵发育五个阶段中的10个DEGs(图2)。通过比较组间花卉发育阶段的DEG及其表达水平,发现BTP中花青素的生物合成和积累主要发生在 BTP3至BTP4之间(图3)。尤其是在花青素合成高峰期,分别有17、4个结构基因上调或下调。
3.WGCNA基因共表达分析和关键基因筛选
使用加权基因共表达网络(WGCNA)对8个关键基因分析,发现这些基因直接影响三种类黄酮化合物的生物合成和积累,分别是矢车菊素-3-O-半乳糖苷、矮牵牛苷3-O-葡萄糖苷、表儿茶素没食子酸酯。这些结果为研究富含花青素茶叶比如紫芽茶树花的着色分子机制提供了线索。
Rothenberg D , Yang H , Chen M , et al. Metabolome and Transcriptome Sequencing Analysis Reveals Anthocyanin Metabolism in Pink Flowers of Anthocyanin-Rich Tea (Camellia sinensis)[J]. Molecules, 2019, 24(6):1064.doi: 10.3390/molecules24061064
热应激(Heat Stress, HS)对鸡的生长性能有负面影响。随着农业扩张,鸡养殖或将分布在气候炎热地区,商业养殖鸡虽能快速生长却表现脆弱。而那些世代生长在高温环境中的土鸡可能具有更强的耐热性。本研究旨在探索能适应两种不同农业气候环境鸡的HS响应机理。
来自肯亚高纬度和低纬度地区土鸡的心肌和骨骼肌,共计64个样本
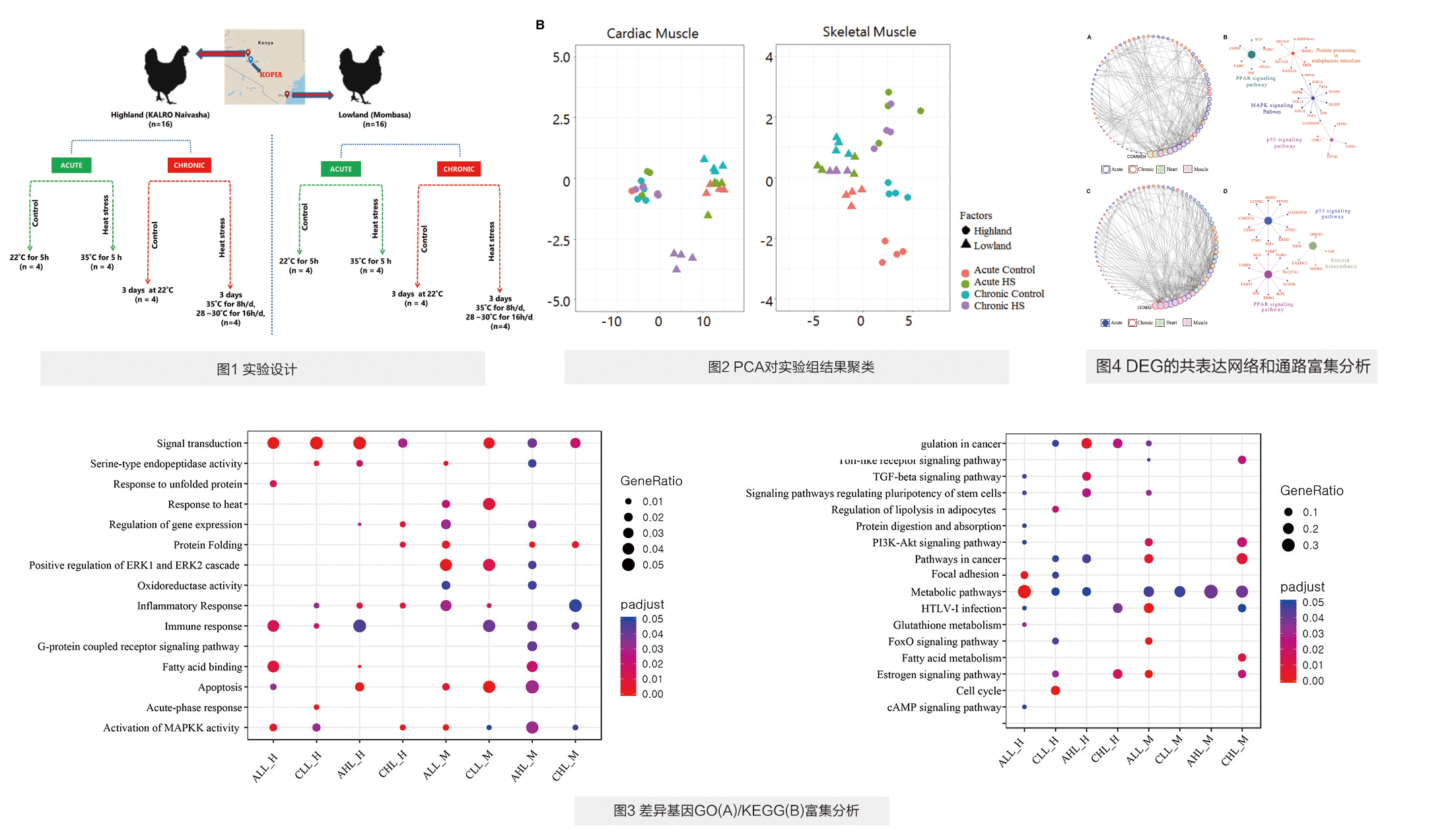
本研究对来自湿热低地和较冷高地地区的32只生态型本地土鸡RNA测序,研究短期(5 h / 35°C)和长期(3 天 / 35°C)热应激对心肌和骨骼肌的影响。来自低地和高地的土鸡分别16只,每组作急性/对照组和慢性/对照组处理(图1),ALL(短期/低地),AHL(短期/高低);CLL(长期/低地)和CHL(长期/高地)共计4组。
1.热应激对低地/高地土鸡基因表达的影响
对不同条件下两类土鸡的所有基因表达量进行PCA分析(图2),结果显示表达量差异大部分来自土鸡品种,小部分来自于热应激效应。
2.对骨骼肌/心肌差异基因分析
实验发现短期组直肠温度升高度数和差异表达基因(DEGs)个数比长期组高两倍,这表明周期性的HS可以诱发实验鸡对环境的适应性。此外,短/长期热应激组具有组织差异和阶段特异性差异,具体表现为在长期组心脏和骨骼肌差异基因分别富集到过氧化物酶体增殖物激活受体(PPAR)信号和丝裂原激活蛋白激酶(MAPK)信号通路,在短期组的心脏和骨骼肌均富集到p53信号通路(图3)。
3.共表达网络分析
实验使用特异性共表达网络(GCN)整合急性和慢性DEGs,鉴定出与低/高地组高度关联的中心基因。GCN基因通路分析指出p53和PPAR信号通路同时存在高/低地调控网络,内质网中MAPK信号传导和蛋白质加工仅在高地组富集。这表明,为了消散积聚热量,减少热量诱导的细胞凋亡并促进DNA损伤修复,这些本地鸡激活或抑制了不同的基因,同时表明了不同生态型鸡的热耐受性和HS响应机制存在差异。
Srikanth K, Kumar H, Park W, et al. Cardiac and Skeletal Muscle Transcriptome Response to Heat Stress in Kenyan Chicken Ecotypes Adapted to Low and High Altitudes Reveal Differences in Thermal Tolerance and Stress Response. Front Genet. 2020;11:197. doi:10.3389/fgene.2019.00993

转录组测序优势:1.基因芯片利用已知序列探针和样本mRNA杂交获得mRNA序列信息,只能探测已知mRNA,而转录组测序不仅可以检测已知mRNA还能检测新mRNA。2.转录组测序在基因表达定量上更为灵敏,还能进行可变剪切,SNP/InDel变异分析。
设置生物学重复可以在很大程度上消除样本的个体差异、系统平台差异,能更准确地检测差异基因。转录组测序实验中建议设置3-4个生物学重复,当结果结果不一致时,可以排除差异较大的个体。
RNA-seq测序数据量与物种转录本数量有关,一般物种即使基因组大小相差很大,但其编码基因数量相差不大,在3万左右。因此对于检测基因表达量,建议数据量10-25 M reads;对于可变剪接,推荐数据量50-100 M reads;对于denovo拼接,建议> 100 M reads。测序长度推荐PE150。
与参考基因组的比对率与多个因素有关,包括基因组组装质量、测序质量、有无污染等;一般来说,与参考基因组的比对效率在70 %以上时,该基因组可以满足后续的分析需求。当比对效率低于60 %时,需要考虑换参考基因组或者按照无参转录组分析策略进行分析。
推荐使用最常见的实时荧光定PCR(qRT-PCR)实验验证转录组测序结果。一般验证15-20个差异基因比较合适,除此之外还有原位荧光杂交(FISH)、Northern blot、基因敲除、敲低、转基因等。
