染色质免疫共沉淀(ChIP)是在体内环境中研究蛋白质与DNA相互作用的经典实验方法,广泛应用于组蛋白修饰、特定转录因子的基因调控作用等相关领域。随着新一代测序技术的发展和成熟,染色质免疫沉淀实验与高通量测序的整合——染色质免疫共沉淀测序(Chromatin Immunoprecipitation Sequencing,ChIP-Seq),可在全基因组范围对蛋白结合位点进行高效而准确的筛选与鉴定,同时也为研究的深入开展打下基础。
采用特异性抗体对目的蛋白进行免疫沉淀后,分离与其结合的基因组DNA片段,再通过高通量测序与数据分析,在全基因组范围内寻找目的蛋白的DNA结合位点,并且可以基于多个样品进行差异比较。


弥漫大B细胞淋巴瘤(DLBCL)是一种异质性疾病,已被区分为至少两个亚组,即生发中心B细胞样(GCB)亚型和活化B细胞样(ABC)亚型。在大约四分之一的DLBCL病例中观察到ch11q24.3反复增加,这导致两个ETS转录因子家族成员ETS1和FLI1的过表达。本研究利用siRNA使ETS1的表达沉默,并结合ChIP-seq数据分析表达变化,以鉴定ETS1直接调控的基因。
标准条件下培养细胞系后获得ABC和GCB表型的DLBCL细胞系,并在一定条件下培养HEK293T细胞;敲除B细胞的ETS1基因;构建shRNA慢病毒质粒,并对HEK293T细胞进行瞬时转染;鉴定细胞活力;提取细胞RNA;反转录后进行qRT-PCR;进行western blot验证转染后细胞;进行染色质免疫共沉淀和转录组分析。
1. 敲除实验鉴定ABC-DLBCL中由ETS1调控的基因
参与浆细胞分化、HIF1α靶点调控和BCR激活基因下调的转录本受ETS1的负调控。参与调控BCR信号、CD40信号、NFκB/TNFα通路、免疫应答以及早期分化的基因的转录本受ETS1的正调控。此外,结果表明参与RNA加工的基因在敲除ETS1后富集。
2. 与ChIP-Seq 数据联合分析证实推测的ETS1直接靶点,并发现它们与BCL6、BLIMP1和PAX5靶点重叠
已有研究利用人类B细胞淋巴母细胞ChIP-Seq数据获得6760个假定的ETS1基因靶点,该结果与本实验鉴定的224个转录本重叠。其中,本研究RNA-seq鉴定出的97个被ETS1正调控、12个被负调控的基因与ChIP-Seq推测的ETS1靶点重叠(图1A)。
3. 新的ETS1靶点FCMR主要在ABC-DLBCL中表达
FCMR是在敲除ETS1后表达量下调最多的基因之一,且在启动子处与ETS1结合,表明FCMR是ETS1的直接靶点。在ABC-DLBCL细胞系中检测到FCMR,在GCB-DLBCL细胞系中未见(图2A),且ABC-DLBCL细胞的FCMR mRNA水平也高于GCB-DLBCL细胞(图2B)。此外,在不同的DLBCL临床标本中,ABC-的FCMR表达始终高于GCB-DLBCL(图2C)。
4. FCMR基因功能分析
在两个细胞系(TMD8和HBL1)中分别独立使用两个shRNA (sh62C和sh62D)抑制FCMR的表达。结果显示敲除FCMR使pETS1和pAKT(Ser473)磷酸化水平下降,并显著影响细胞的增殖。

Priebe V, Sartori G, Napoli S, Chung E Y et al. Role of ETS1 in the Transcriptional Network of Diffuse Large B Cell Lymphoma of the Activated B Cell-Like Type. Cancers. (2020). doi: 10.3390/cancers12071912
许多经过人工选择、驯化的作物与它们的野生祖先相比,植株分蘖大大减少,顶端优势增加。这使得作物积累更多的能量用于营养生长阶段。在玉米中,分蘖数的减少是由于功能获得突变等位基因TB1发挥作用。顶端优势主要是侧生分生组织被生长素途径抑制的结果,故这个过程与植物激素密切相关。但TB1显性等位基因增加顶端优势的具体机制尚不清楚。本研究针对该问题展开研究,旨在解析TB1调控的下游基因以及它所参与的代谢通路。
获取玉米自交系B73(对照组)和TB1突变的B73植株(实验组)的腋芽组织;提取RNA;分别进行mRNA-seq与ChIP-seq;进行qRT-PCR验证RNA-seq结果;进行EMSA、ChIP-qPCR验证ChIP-seq结果;使用HPLC-MS分析腋芽的激素和糖类物质组成;构建由基因到转录到代谢到表型的代谢通路。
1. TB1调节植物激素相关基因以及糖类代谢相关基因的表达水平
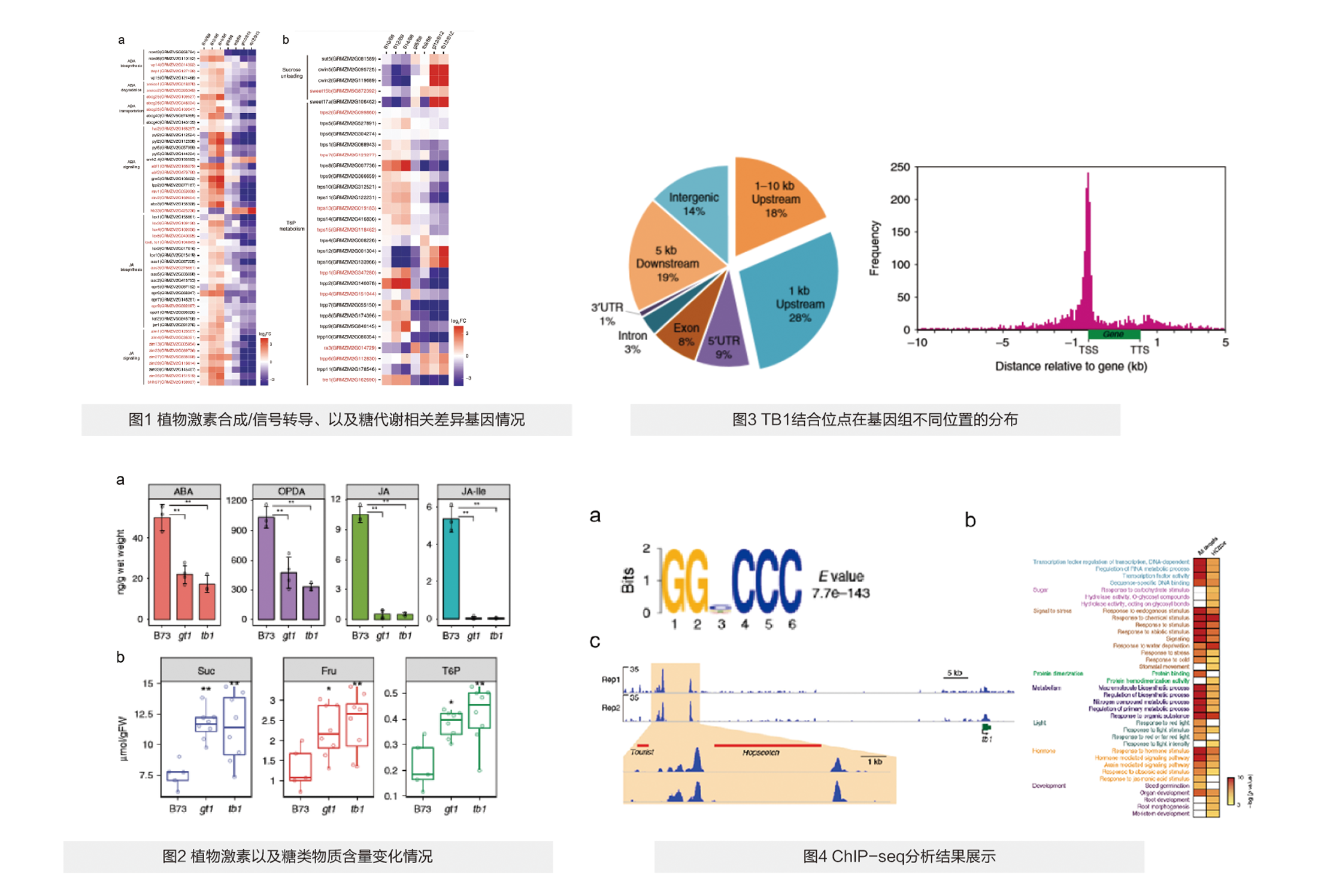
与对照组相比,TB1突变的B73植株中的脱落酸、茉莉酸的合成、降解、信号转导相关基因表达量下调,与糖类代谢相关的基因也发生了差异表达。这些基因在不同阶段(B10,B12,B14,gt8,gt12,tb12)的表达谱如图1所示。
2. TB1调节植物激素与糖类物质的含量水平
与对照组相比,TB1突变的B73植株中的脱落酸、茉莉酸和它们的同系物(OPDA、JA-ILE)含量降低,相反蔗糖、果糖、6-磷酸葡萄糖的含量升高(图2)。
3. TB1整合了多个驯化位点
TB1的主要结合区域为Promotor区(图3),从peak中鉴定出了多个与植物株型相关的基因gt1、tga1、tru1,并且鉴定出Binding-Motif GGNCCC(图4a)。GO分析表明,ChIP-seq Peak与差异表达基因重叠部分的基因主要与植物的光响应,激素合成途径,糖类合成等途径相关(图4b)。最后,发现TB1可以结合在自己的远端调控区调节自身的表达(图4c)。
4. 鉴定circRNAs的编码潜能
使用IRESfinder分析环状RNA的蛋白编码潜能,得到3,556个得分大于0.5的circRNAs。在此基础上,分别使用CPC,CNCI和PFAM软件鉴定了39,307个和2,019个具有编码潜能的circRNA。 最终,通过三种软件同时鉴定了11个具有编码潜能的circRNAs。
Dong, Z., Xiao, Y., Govindarajulu, R. et al. The regulatory landscape of a core maize domestication module controlling bud dormancy and growth repression. Nat Commun 10, 3810 (2019). doi:10.1038/s41467-019-11774-w

基因拼接至染色体水平,且注释完整的2倍体物种即可做ChIP-Seq。
Input样本是在进行免疫沉淀前取的一部分断裂后的染色质(不进行免疫沉淀),是断裂后的基因组DNA,IP样本是经过免疫沉淀过程后获得的DNA。这两种样本都要经过逆转交联、DNA纯化、以及后续检测。Input样本可作为对照去排除背景噪音、去验证染色质断裂和整个实验中IP效果,因此,Input对照是ChIP实验必不可少的。
抗体的质量与特异性、需要富集的目标区域在基因组上的比例、ChIP的实验操作、DNA片段长度范围、测序通量、测序质量等都会影响ChIP-Seq的结果。
