蛋白质翻译后修饰是指在蛋白质翻译过程中或者翻译完成后的化学修饰过程,在这个过程中可以给蛋白添加磷酸酯等功能基团,从而增加蛋白质的类型,让生命过程更复杂。翻译后修饰在生命体中具有非常重要的意义,可调节被修饰蛋白的稳定性和功能活跃性。常见的蛋白质修饰有磷酸化、N-糖基化等。通过富集处理和质谱技术,可对这些翻译后修饰进行检测。我们可提供酰化、泛素化、乙酰化和甲基化等翻译后修饰的检测服务。

蛋白磷酸化修饰Phoshlorylation是目前修饰组学中最常见,应用最广泛的修饰。在激酶的催化下,ATP上的磷酸根基团转移到蛋白的氨基酸( Ser, Tyr, Thr)侧链上,则完成磷酸化修饰。发生了磷酸化修饰的氨基酸上共价连接分子量79.9 Da 的磷酸基团。

酰基CoA的酰基官能团转移至蛋白质氨基酸残基上的反应成为乙酰化修饰,多发生在代谢酶上,可对下游代谢物的产生进行调控,受到代谢环境的影响。

蛋白质糖基化Glycosylation分为N-糖基化及O-糖基化两个大类,可通过改变蛋白折叠定位等方式,调控蛋白功能。在糖基转移酶作用下,N-糖基化修饰类型由N-糖链与天冬氨酸的自由基-NH2共价连接,形成糖苷键。

泛素化修饰Ubiquitination是在泛素激活酶E1、结合酶E2、连结酶E3及降解酶的作用下,将细胞内的蛋白质分类,从中选出靶蛋白分子,并将一个或多个泛素分子( Ubiquitin,由76个氨基酸组成的多肽)连接到蛋白氨基酸侧链上。泛素化的产生会引起蛋白结构变化,进而影响其稳定性,可参与生物增值凋亡,免疫应答等调控过程。

与基因的甲基化不同,蛋白甲基化Methylation修饰的是组蛋白、转录因子等蛋白,通过甲基转移酶的作用,将甲基转移至蛋白氨基酸残基上,多见于赖氨酸及精氨酸。


*注:为保证修饰片段富集足够,蛋白修饰组学的样本起始量需求较大。如样本珍贵或情况特殊,请与我们沟通。


淡水稀缺是灌溉水稻日益受到关注的问题,而过量使用氮肥成本高昂,还会造成环境污染。为协调缺水或过量氮供应下的生长,植物采用复杂的系统来调节代谢过程。目前,蛋白质磷酸化在这个过程中发挥的作用知之甚少。
日本晴水稻(Oryza sativa cv. Nippon bare)旗叶
将水稻种植在经两种浓度的硝酸铵各自处理的土壤中,硝酸铵的浓度分别为250( N250)和750( N750) mg N ,对两种种植条件下的水稻进行充分浇水(WW)至饱和或者缺水(WD)处理。收取种植51天后的水稻旗叶样本,对提取的蛋白质消化后,使用二氧化钛( TiO2)法富集磷酸化肽段,并对其进行检测后分析。
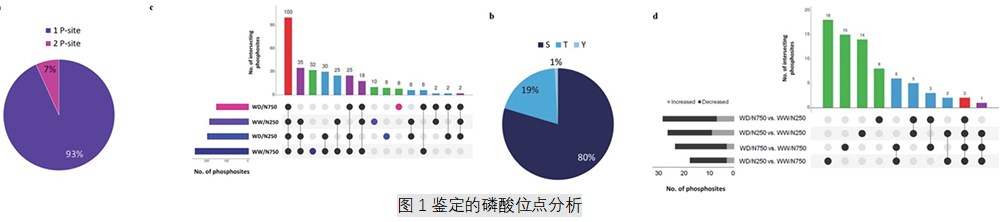
1.缺水条件下两种氮处理水稻叶片中磷酸肽的鉴定
对选择性富集磷酸肽进行磷酸化蛋白质组分析,在两个技术重复和三个生物学重复中进行nano LC-MS/MS分析。共鉴定401个磷蛋白上的2232个磷酸位点。大多数鉴定出的磷酸位点是单磷酸化肽(93%) ,其余7%是双磷酸化。在鉴定出的磷酸位点中,丝氨酸上有80%磷酸化,苏氨酸上有19%磷酸化,酪氨酸上只有1%磷酸化。 四种处理中都存在的磷酸盐有100个。在四个比较中发现在干旱胁迫下,质膜H+-ATPase ( Q7×PY2)上的Thr881和肌球蛋白-17 ( A0A0P0W1J8)上的Ser1077的磷酸化降低(图1)。
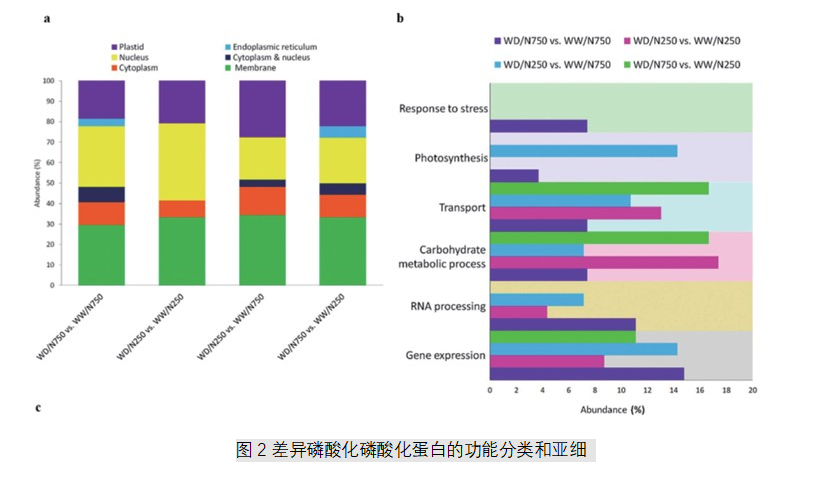
2.不同条件下磷酸盐的功能分析和亚细胞定位
对不同处理条件下的样本进行磷酸化蛋白差异比较,对这些差异蛋白的亚细胞定位和指定生物学过程进行分析,结果发现鉴定出的磷酸化蛋白主要位于细胞膜或细胞核中。在基因表达功能方面,RNA加工和mRNA代谢加工是主要类别(图2)。
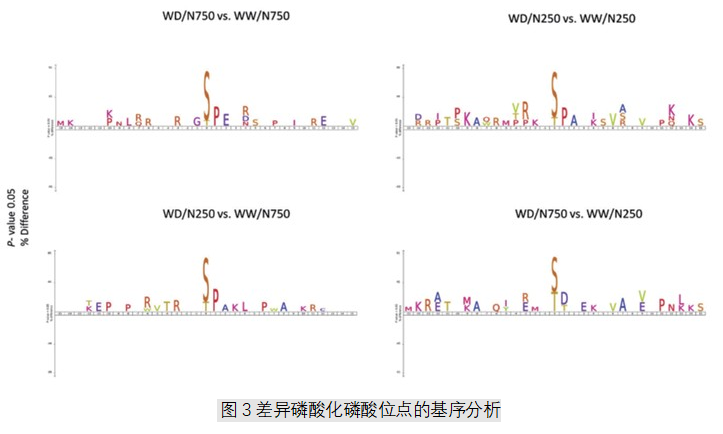
3.差异显著磷酸盐的基序分析
在所有四组比较中对显著变化的磷酸盐进行基序分析,结果显示,在磷酸化的丝氨酸和苏氨酸残基附近有很多脯氨酸和精氨酸(图3)。除了WD/N750 VS WW/N250之外,脯氨酸基序( ( S/T) /P)也富集。
Sara Hamzelou, Vanessa J Melino, Darren C Plett, et al. The phosphoproteome of rice leaves responds to water and nitrogen supply. Mol Omics. 2021 Oct 11;17(5):706-718. Mol Omics. 2021 Oct 11;17(5):706-718. doi: 10.1039/d1mo00137j.

神经母细胞瘤是交感神经系统高度异质性的胚胎实体瘤。表达原肌球蛋白相关激酶A ( TrkA)的神经母细胞瘤细胞在高亲和力配体神经生长因子(NGF)的刺激下会进行分化。研究这一过程可以指导基于分化的神经母细胞瘤治疗。Casitas B细胞淋巴瘤蛋白Cbl蛋白家族由三个成员组成:c-Cbl(称为Cbl) , Cbl-b和Cbl-3。之前已经确定Cbl-b在神经母细胞瘤细胞中作为NGF-TrkA信号的负调控因子,并发现Cbl 和Cbl-b的缺失与神经突生长的诱导相关。本研究中,研究E3泛素连接酶Cbl和Cbl-b在调节与细胞外信号调节激酶磷酸化等方面的作用。
三种神经母细胞瘤细胞系SH-SY5Y,NB1和IMR-32
使用基于定量质谱(MS)的蛋白质组学,分析神经母细胞瘤细胞系蛋白质组、磷酸化蛋白质组和泛素组如何受到Cbl和Cbl-b缺失的影响。开发了一种高通量显微镜检测方法用于定量轴突生长,该方法与抑制剂研究相结合,用于确定轴突生长的信号传导,并在功能上验证MS数据集中鉴定的蛋白质。
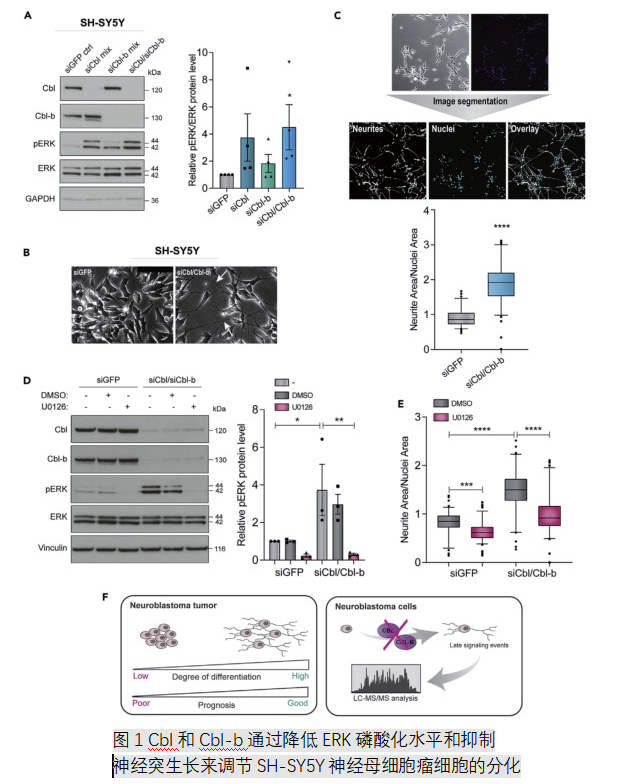
1.E3泛素连接酶Cbl和Cbl-b以ERK依赖性方式调节神经母细胞瘤细胞中的神经突生长
通过小干扰RNA ( siRNA)干扰法降低Cbl和/或Cbl-b的功能,结果发现两者的功能降低都诱导了所有细胞系中神经突生长的增加,细胞外信号调节激酶(ERK)磷酸化也随之增加。Cbl和Cbl-b两者同时可增加分化反应的强度和稳定性(图1)。
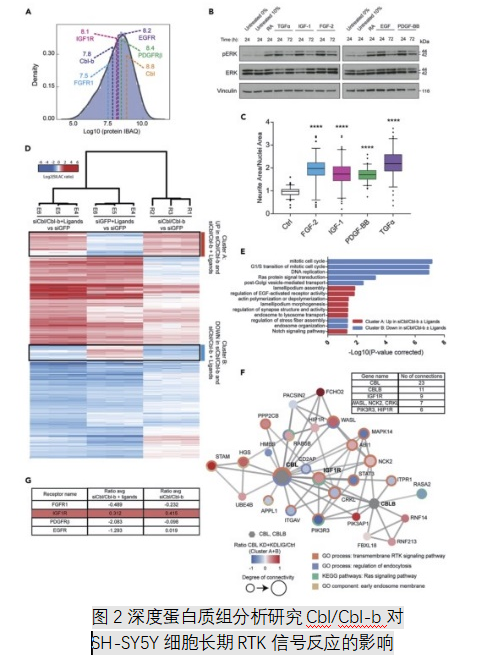
2.蛋白质组的变化将Cbl蛋白与长期细胞反应的调节联系起在一起)
已知Cbl蛋白家族通过调节RTK内化和降解来调节几种RTK的信号传导反应,基于既往研究在我们的SH-SY5Y细胞系中选择集中潜在的RTK11候选蛋白panel,包括表皮生长因子受体(EGFR) , 膜岛素样生长受体(IGF 1R) ,血小板衍生生长因子受体b ( PDGFRb)和成纤维细胞生长因子受体1(FGFR1)作为RTKs差异表达,并用各自的配体刺激细胞。结果发现,在24-72小时的长期刺激下会诱导ERK磷酸化并增加神经突生长。
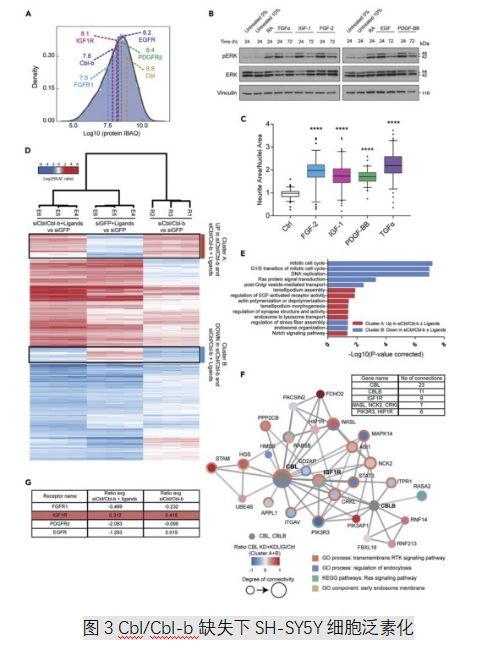
3. Cbl蛋白耗竭后泛素化的整体变化分析
Cbl和Cbl-b充当E3泛素连接酶,泛素化的主要功能是调节蛋白质的稳定性和降解。通过富集泛素化肽,鉴定并量化了分布在2486种蛋白质上的6546个泛素化位点。siCbl/Cbl-b处理后在泛素化和72小时蛋白质组中检测的同时发生变化的蛋白有76种(图3) ,对这76种蛋白质的功能网络分析显示,与Cbl和Cbl-b连接的几种蛋白质显示出不同水平的泛素化和蛋白质丰度调节,且18种呈负相关。
Anna-Kathrine Pedersen, Anamarija Pfeiffer, Gopal Karemore, et al. Proteomic investigation of Cbl and Cbl-b in neuroblastoma cell differentiation highlights roles for SHP-2 and CDK16. iScience. 2021 Mar 17;24(4): 102321. doi: 10.1016/j.isci.2021.102321. eCollection 2021 Apr 23.
