N6-甲基腺嘌呤(N6-methyladenosine,m6A)是真核生物mRNA最普遍的一种甲基化修饰,主要富集在mRNA的启动子区、终止密码子区以及RRACH motif内。m6A甲基化修饰在mRNA的剪接、出核、定位、翻译等方面扮演重要角色,对于细胞分化、生物发育和压力应答等过程意义重大。
MeRIP-seq(RNA甲基化测序)是利用m6A特异性抗体免疫共沉淀捕获细胞内具有m6A修饰的RNA片段,并对富集的RNA片段进行高通量测序,以在全转录组范围内对发生m6A修饰区域的进行系统检测、研究的技术。


肠道微生物群调节宿主的生理机能和基因表达的机制尚不明确。本研究使用MeRIP-seq技术鉴定携带常规的微生物(CONV)、改良的微生物、以及不携带微生物(GF)的小鼠的mRNA中m6A修饰情况,以检查宿主表观转录组标记是否受肠道微生物影响。
C57BL/6J鼠购自Charles River;由C57BL/6J鼠产生无菌鼠(来自法国奥尔良CNRS TAAM UPS44或巴斯德研究所的细胞生物学平台);常规鼠在特定的无病原体条件下饲养获得。
培养细菌;在一定光周期下处理实验小鼠;制备三组小鼠;提取总RNA后获取纯净的mRNA;分析核苷成分;对制备RNA的组织进行WB实验;进行蛋白组学分析;进行m6A甲基化mRNA的免疫沉淀;qRT-PCR扩增;制备文库并进行MeRIP-seq;m6A peak检测;差异甲基化和表达分析;motif分析;16S rRNA测序;定量与数据分析。
1. 盲肠和肝脏中m6A的修饰概况
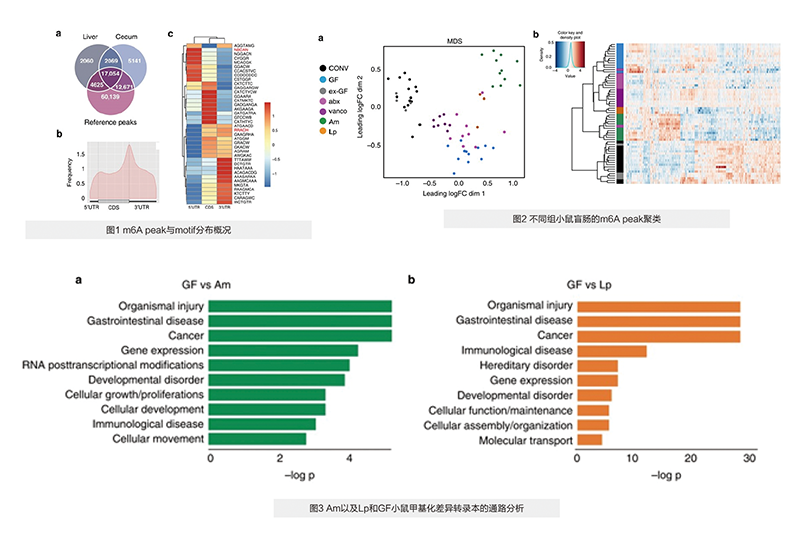
从盲肠和肝脏样本中检测到大量m6A修饰的peak,且在很大程度上与参考数据库重叠(图1a),盲肠中m6A修饰主要存在于mRNA的CDS和3’ UTR 区(图1b),热图展示了motif在5’ UTR区、CDS区 以及 3’ UTR区的存在情况(图1c)。
2. 肠道微生物控制小鼠盲肠中的m6A修饰
MDS分析显示CONV和GF鼠的盲肠m6A peak分类明显(图2a),分层聚类热图显示CONV和GF鼠盲肠转录本差异显著(图2b)。
3. 不同的细菌种类影响m6A的修饰
接种了不同单一菌群的小鼠(Am与Lp组)的m6A修饰显著与GF鼠和abx鼠(被抗生素处理的CONV鼠)分离,并自成一簇(图2a)。热图中Am和Lp组能更明显地从GF和abx组中单独聚类(图2b)。
4. 微生物群在代谢和炎症通路中调控m6A
肠胃疾病、癌症以及免疫系统疾病均受Am和Lp的显著影响(图3)。Lp诱导参与细胞功能和维持、细胞组装和基因表达等转录本的差异甲基化,影响与细胞生长、增殖、凋亡相关转录本的甲基化。Am影响参与RNA转录后修饰的转录本。
Jabs, S., Biton, A., Bécavin, C. et al. Impact of the gut microbiota on the m6A epitranscriptome of mouse cecum and liver. Nat Commun 11, 1344 (2020). doi:10.1038/s41467-020-15126-x
结直肠癌(CRC)是全球肿瘤相关死亡的主要原因之一,其主要致死原因是远处转移。甲基转移酶样蛋白14抗体(METTL14),一种主要的RNA N6-腺苷-甲基转移酶,通过调节RNA功能参与肿瘤发展。本研究旨在揭示METTL14在CRC中的生物学功能及分子机制。
NCM460、HCT116、HCT8、SW620、SW480、HT29、DLD-1细胞系均取自American Type Culture Collection(ATCC)。
进行qRT-PCR、WB以及免疫组化(IHC)实验检测CRC细胞系与组织中的SOX4和METTL14;用体外、体内实验证明METTL14的生物学功能;用ChIP、RNA-seq、MeRIP-Seq、RNA免疫沉淀和荧光素酶报告基因揭示METTL14的作用机制。
1. METTL14在CRC中低表达,并与CRC发展相关
CRC组织中METTL14的表达水平显著低于非肿瘤组织(图1),且CRC组织中METTL14在mRNA和蛋白水平上的表达均显著高于癌旁正常组织(图2a-b),这与淋巴结转移、远处转移以及TNM分期显著相关。METTL14低表达的CRC患者总生存率(OS)低(图2c)。
2. KDM5C介导的脱甲基化H3K4me3抑制METTL14的转录
CRC细胞中启动子区H3K4me3的富集明显低于正常结直肠组织。KDM5C(催化H3K4me3脱甲基化来抑制基因转录)的mRNA表达在CRC组织中显著上调,且研究结果显示METTL14的表达与KDM5C的表达显著负相关。
3. METTL14抑制CRC细胞迁移、侵袭和转移
过表达METTL14会显著阻碍HCT116和HCT8细胞的迁移能力,并抑制这两种细胞的侵袭能力。敲除METTL14会显著提高HCT116和HCT8细胞的迁移速度,并增强它们的侵袭能力(图3)。
4. SOX4是METTL14的下游靶点
在METTL14敲除的HCT116和HCT8细胞中,SOX4在mRNA和蛋白水平上均显著上调。MeRIP-seq结果显示,未敲除METTL14时,m6A peak 出现在SOX4 mRNA终止密码子附近,敲除METTL14后m6A peak减少(图4)。
5. METTL14敲低通过m6A-YTHDF2-依赖的途径提升SOX4 mRNA的稳定性
野生型(有m6A修饰)而非突变型(无m6A修饰)SOX4的转录水平随METTL1的缺失而增加,说明对METTL14依赖m6A修饰调控SOX4水平(图5)。此外,METTL14可以将YTHDF2(SOX4的靶点)上调到SOX4 mRNA的 m6A修饰位点,调节SOX4的表达。

Chen, X., Xu, M., Xu, X. et al. METTL14-mediated N6-methyladenosine modification of SOX4 mRNA inhibits tumor metastasis in colorectal cancer. Mol Cancer 19, 106 (2020). doi.org/10.1186/s12943-020-01220-7

(1) 首先要确保送样物种有参考基因组,且基因组拼接至染色体水平、注释完整(基因水平,有外显子、内含子、 CDS)。
(2) 取下组织样品后,快速用RNase-free配制的生理盐水/PBS清洗表面污渍,并吸干表面的液体,迅速将样本分割小块(长宽高 ~0.5 cm),将样本放入已标记好名称且预冷好的Rnase-free的螺纹管中(不要将盖子拧的太死,以免从液氮中取出时破裂),迅速投入液氮中速冻1小时以上,然后取出置于-80℃保存,干冰运输。若实验室无液氮,则需提前准备好存有1 mL RNAfixer的1.5 mL EP管(RNase-free)。在分割成小块后,迅速投入提前准备好的EP管中,使样本完全浸没在液体中,然后置于-80℃中保存,干冰运输。
(3) 实验操作过程中请务必确保无RNA酶污染。为确保实验顺利,建议样品备份1~2 份(以防备部分样品降解重新取材、制备或送样,耽误时间,也防止RNA得率低而导致总量不足)。
IP 样品是用m6A 抗体特异性富集甲基化修饰的 RNA片段,Input仅仅是片段化的 RNA(用作消减背景噪音的对照),二者需同时进行建库和测序。需整合两个样本的数据进行峰检测分析,利用Input数据排除本底表达水平高或非特异性结合的Peaks,以提高Peak Calling的准确性。
